Nessa onda de protestos, não me atrevo a comentar. Não sei o que está acontecendo, e, se alguém não está confuso, está mal informado. Física nenhuma explica a maior parte das mobilizações, estranhamente súbitas, pacíficas ou violentas, justificadas ou casuais. Ninguém consegue me dizer se o que vejo é a segunda revolução francesa ou uma micareta da classe média, então também não arrisco. Ainda, como físico estatístico, fenômenos coletivos dessa sorte sempre me interessam. Hoje falo de um de meus favoritos, o vento, e tento tirar algumas lições da física das moléculas do ar.
Em uma aula minha sobre termodinâmica, eu explicava, em meu jeito empolgado característico de quando falo de termodinâmica, que temperatura é o movimento dos átomos; que quanto mais quente, mais rápidos eles estão. Uma aluna não gostou, não concordou, e, comparando com sua experiência, decidiu perguntar: “Mas se o vento é o ar em movimento, por que ele é frio?”. Ah, que pergunta complicada.
E um dos problemas da pergunta foi induzido por mim, quando, simplificando, compliquei. Dizendo que temperatura e velocidade são a mesma coisa, esqueci de dizer que o ar, como todo gás, possui moléculas em velocidades altas indo de um lado para o outro. O ar entre seu rosto e o computador, por mais parado que pareça, está a uma velocidade mais alta que qualquer carro de corrida, mais alta que a maior parte dos aviões.
No século XIX, os grandes da física estatística acreditaram na teoria atômica, uma noção ainda controversa na época. Eles acreditaram que o ar é feito de átomos e que a temperatura vem do movimento dessas partículas, que o calor não é uma partícula, mas como as partículas se movem. Maxwell, o maior dentre nós naquele século, tomou coragem, acreditou em suas equações e deduziu a velocidade média dos átomos no ar: algo perto de 500m/s. Não apenas ele calculou a média, ele determinou a densidade de probabilidade dessa velocidade. Essa densidade, conhecida como distribuição de Maxwell-Boltzmann, tem essa cara:
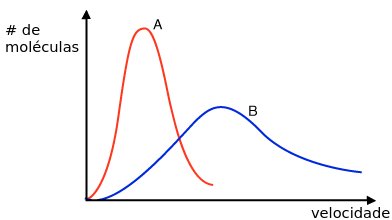 Nesse gráfico, a distribuição A significa um gás em temperatura menor, enquanto o B representa um mais quente. É fácil ver que no B haverá mais moléculas com mais velocidade, e no A as moléculas estarão mais concentradas em regiões de velocidade mais baixa. Maxwell descobriu isso usando apenas matemática, um feito impressionante em uma época em que a própria existência dos átomos era questionada. Como de costume, ele tinha razão, ainda que nenhuma verificação disso fosse possível na época. Maxwell deduziu o que seria a distribuição de velocidades de partículas se movendo em direções aleatórias e cujas colisões seriam como as de bolas de bilhar; sendo esse gráfico o resultado da colisão de muitas, muitas dessas partículas.
Nesse gráfico, a distribuição A significa um gás em temperatura menor, enquanto o B representa um mais quente. É fácil ver que no B haverá mais moléculas com mais velocidade, e no A as moléculas estarão mais concentradas em regiões de velocidade mais baixa. Maxwell descobriu isso usando apenas matemática, um feito impressionante em uma época em que a própria existência dos átomos era questionada. Como de costume, ele tinha razão, ainda que nenhuma verificação disso fosse possível na época. Maxwell deduziu o que seria a distribuição de velocidades de partículas se movendo em direções aleatórias e cujas colisões seriam como as de bolas de bilhar; sendo esse gráfico o resultado da colisão de muitas, muitas dessas partículas.
Maxwell não pôde checar isso, mas eu posso. Não sou uma fração do físico que foi Maxwell, mas meu celular tem mais poder computacional que a NASA quando enviou o homem à Lua, isso deve me ajudar. Escrevi novamente um pequeno código com as seguintes configurações: temos bolinhas em diversas velocidades indo para todos os lados, elas colidem e trocam energia e momento nessas colisões. A energia total se conserva e o momento também, o que torna todas as colisões perfeitamente elásticas, como se eu tivesse programado um grande jogo de bilhar sem caçapas. Também fiz um gráfico da velocidade de cada bolinha, um histograma, que diz quantas bolinhas possuem aquela velocidade naquele instante. Como elas se movem, o histograma muda, mas, usando bem pouco de sua imaginação, você pode perceber que ele é exatamente a distribuição de Maxwell-Boltzmann.
Novamente, coloquei em um link à parte para não pesar seu navegador. Essa simulação é mais complicada e eu recomendo fortemente que você use o navegador Chrome para que ela fique mais fluída. Mais uma vez, bonus round! Você pode mexer nas bolinhas e, dando energia, aumentar a temperatura, que aparece no gráfico em amarelo! Com isso, consegue perceber exatamente que temperatura é a velocidade das partículas, que era o que queria explicar a minha aluna.
O vento é um tipo diferente de movimento. Enquanto as partículas se mexem aleatoriamente em alta velocidade, se eu coloco uma tendência nelas a irem para um lado, se eu coloco uma pequena diferença entre esquerda e direita, então há o que chamamos de vento. Mas note que qualquer brisa é profundamente mais lenta que a velocidade individual de qualquer molécula, um tornado não chega perto de reproduzir a velocidade nem de uma partícula lenta que compõe aquela grande massa de ar.
O vento é frio porque ele, atingindo sua pele, rouba aquela camada de ar já aquecido que a cobria e força sua pele a esquentar essa nova camada de ar; com isso, perdendo calor no processo. O vento não é frio, você sente que ele é frio porque perde calor, mas essa sensação é uma ilusão. Encostar em um metal ou em uma borracha pode fazer parecer com que o metal esteja mais frio, mas a situação é a mesma; ambos estão na mesma temperatura, mas um rouba mais calor seu que o outro.
Pessoas são mais parecidas com átomos do que gostariam. Em toda aglomeração há gente de todo o espectro político, muitas em alta temperatura, algumas motivadas demais, que até causam estragos. E há pessoas passivas, apáticas, e cada uma em sua direção. Em primeiro lugar, não se pode julgar um gás pelas partículas que estão com temperatura duas, três, cinco vezes a temperatura média. Acredite, no ar à sua frente, há partículas com velocidades superiores a 5.000Km/h, elas poderiam fazer você entrar em combustão expontânea, mas são uma minoria. Em segundo lugar, um gás, sozinho, não vai a lugar nenhum; é necessário haver uma tendência para irem para o lado; você não sente as partículas, sente apenas o vento. Tenha sempre ciência de que seguir apenas a direção que lhe dá na telha contribui apenas como um ruído aleatório na estatística, um desvio esperado da média, que será compensado por quem pensa no oposto e está presente; é preciso consenso, foco, ou seremos apenas partículas ricocheteando em uma caixa. E, em terceiro lugar, não podemos nos esquecer da termodinâmica: apenas em alta temperatura é possível uma mudança de estado.